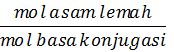Tahukah kalian bahwa sebenarnya dalam darah terdapat sistem penjaga yang membantu supaya pH darah hampir konstan, yaitu 7,4?
Ya, sistem penjaga itu merupakan larutan penyangga. Larutan penyangga sangat dibutuhkan untuk mempertahankan keadaan pH karena apabila terlalu asam atau terlalu basa dapat menimbulkan berbagai masalah.
Apakah larutan penyangga itu? Mari kita bahas pada materi berikut.
Contents
Pengertian Larutan Penyangga
Larutan penyangga adalah larutan yang mampu mempertahankan derajat keasaman (pH) pada saat asam atau basa dimasukkan dalam suatu larutan. Larutan penyangga disebut juga “buffer” atau “penahan”.
Berikut ini yang termasuk dalam larutan buffer.
1. Campuran asam lemah dengan garam yang berasal dari asam lemah tersebut.
Contoh :
CH3COOH dengan CH3COOK
2. Campuran basa lemah dengan garam yang berasal dari basa lemah tersebut.
Contoh :
NH4OH dengan (NH4)2SO4
Larutan buffer memiliki sifat-sifat sebagai berikut.
- Jika diencerkan maka pH larutan hanya sedikit berubah bahkan tidak terjadi perubahan.
- Jika ditambahkan ke dalamnya sedikit asam atau basa maka pH larutan hanya sedikit berubah bahkan tidak terjadi perubahan.
Dengan sifat-sifat tersebut, tentunya larutan buffer memiliki bermacam fungsi supaya pH larutan tetap stabil/konstan.
Baca juga Hidrokarbon.
Fungsi Larutan Penyangga
Larutan penyangga memiliki bermacam fungsi, antara lain :
1. Darah sebagai Larutan Penyangga
Terdapat faktor-faktor dalam pengendalian pH darah, antara lain penyangga karbonat, penyangga hemoglobin, dan penyangga fosfat.
a. Penyangga karbonat
Penyangga karbonat berasal dari campuran asam karbonat (H2CO3) dengan basa konjugasi bikarbonat (HCO3–). Reaksinya sebagai berikut.
H2CO3 (aq) → HCO3– (aq) + H+ (aq)
Penyangga karbonat berperan penting dalam mengatur pH darah supaya tetap konstan.
b. Penyangga hemoglobin
Hemoglobin dalam darah dapat mengikat oksigen untuk dibawa ke seluruh sel tubuh. Reaksi kesetimbangannya sebagai berikut.
HHb + O2 (g) → HbO2– + H+
Adanya oksigen yang bersifat basa pada reaksi tersebut memengaruhi konsentrasi ion H+ sehingga pH darah juga dapat dipengaruhi.
c. Penyangga fosfat
Dalam cairan intrasel, penyangga fosfat berperan penting dalam mengatur pH darah. Penyangga fosfat berasal dari campuran dihidrogen fosfat (H2PO4–) dengan monohidrogen fosfat (HPO32-). Reaksinya sebagai berikut.
H2PO4– (aq) + H+ (aq) → H3PO4 (aq)
H2PO4– (aq) + OH– (aq) → HPO32- (aq) + H2O (aq)
Penyangga fosfat dapat mempertahankan pH darah 7,4. Penyangga di luar sel sangat sedikit jumlahnya namun penting sekali untuk larutan penyangga urin.
2. Air Ludah sebagai Larutan Penyangga
Air ludah mengandung larutan penyangga fosfat yang dapat menjaga gigi dari kerusakan akibat adanya zat asam yang terbentuk dari fermentasi sisa-sisa makanan pada sela-sela gigi. Air ludah dapat mempertahankan pH mulut sekitar 6,8.
3. Menjaga Keseimbangan pH Tanaman
Setiap tanaman dapat tumbuh dengan baik dalam pH tertentu sehingga dibutuhkan larutan penyangga agar pH dapat dijaga agar konstan.
4. Larutan Penyangga pada Obat-Obatan
Obat-obatan apabila tidak mengandung larutan penyangga dapat menyebabkan perubahan pH pada perut, sehingga dapat memicu permasalahan lain dalam tubuh. Sehingga larutan penyangga ditambahkan dalam obat-obatan supaya dapat mentransfer kelebihan asam atau basa yang berasal dari kandungan obat tersebut.
Derajat keasaman atau pH larutan penyangga dapat diketahui. Begitupula pH dari larutan penyangga yang telah ditambahkan sedikit asam atau basa. Bagaimana caranya? Mari kita pelajari pada subbab berikut.
Rumus Larutan Penyangga
1. Buffer asam (asam lemah + basa konjugasinya)
[H+] = Ka . 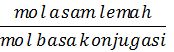
pH = – log [H+]
2. Buffer basa (basa lemah + asam konjugasi)
[OH–] = Kb . 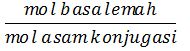
pOH = – log [OH–]
pH = 14 – pOH
Baca juga Konfigurasi Elektron.
Contoh Soal Larutan Penyangga
Sebanyak 200 ml larutan penyangga mangandung NH3 dan NH4Cl masing-masing 0,05 M.
- Tentukan pH larutan tersebut
- Tentukan pH larutan setelah ditambah 2 ml HCl 0,05 M
- Tentukan pH larutan setelah ditambah 2 ml NaOH 0,05 M
(Kb NH3 = 1 . 10-5)
Jawaban
1. Menentukan pH Larutan
mmol NH3 = M . V = 0,05 . 200 = 10 mmol
mmol NH4Cl = M . V = 0,05 . 200 = 10 mmol
NH4Cl → NH4+ + Cl–
(garam) (asam konjugasi)
10 mmol 10 mmol
[OH–] = Kb . 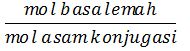 [OH–] = 10-5 .
[OH–] = 10-5 . ![]() [OH–] = 10-5
[OH–] = 10-5
pOH = – log [OH–]
pOH = – log 10-5
pOH = 5
pH = 14 – pOH
pH = 14 – 5
pH = 9
Jadi, pH larutan penyangga tersebut adalah 9.
2. Menentukan pH larutan setelah ditambah 2 ml HCl 0,05 M
mmol HCl = M . V = 0,05 . 2 = 0,1 mmol
HCl → H+ + Cl–
0,1 mmol 0,1 mmol
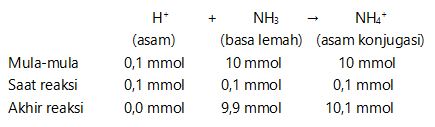
[OH–] = Kb . 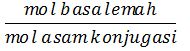 [OH–] = 10-5 .
[OH–] = 10-5 . ![]() [OH-] = 10-5 . 0,9802
[OH-] = 10-5 . 0,9802
pOH = – log 10-5. 0,9802
pOH = – log 10-5 – log 0,9802
pOH = 5 – (-0,0087)
pOH = 5,0087
pH = 14 – pOH
pH = 14 – 5,0087
pH = 8,9913
Jadi, pH larutan penyangga setelah ditambah larutan HCl tersebut adalah 8,9913.
3. Menentukan pH larutan setelah ditambah 2 ml NaOH 0,05 M
mmol NaOH = M . V = 0,05 . 2 = 0,1 mmol
NaOH → Na+ + OH–
0,1 mmol 0,1 mmol
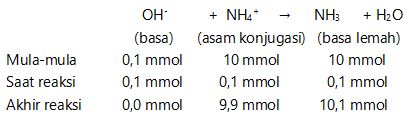
[OH–] = Kb . 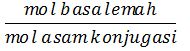 [OH–] = 10-5 .
[OH–] = 10-5 . ![]() [OH-] = 10-5 . 1,0202
[OH-] = 10-5 . 1,0202
pOH = – log 10-5 . 1,0202
pOH = – log 10-5 – log 1,0202
pOH = 5 – log 1,0202
pOH = 5 – 0,0087
pOH = 4,9913
pH = 14 – pOH
pH = 14 – 4,9913
pH = 9,0087
Jadi, pH larutan penyangga setelah ditambah larutan NaOH tersebut adalah 9,0087.
Dari perhitungan-perhitungan di atas, terbukti bahwa dengan ditambahkannya sedikit asam atau basa ke dalam larutan penyangga, pH relatif konstan.
Demikian pembahasan mengenai larutan penyangga. Semoga dapat bermanfaat. Baca juga Ikatan Hidrogen.
website Pelajaran SD SMP SMA dan Kuliah Terlengkap
mata pelajaran
jadwal mata pelajaran mata pelajaran sma jurusan ipa mata pelajaran sd mata pelajaran dalam bahasa jepang mata pelajaran kurikulum merdeka mata pelajaran dalam bahasa inggris mata pelajaran sma jurusan ips mata pelajaran sma
bahasa inggris mata pelajaran
bu ani memberikan tes ujian akhir mata pelajaran ipa
tujuan pemberian mata pelajaran pendidikan kewarganegaraan di sekolah adalah
dalam struktur kurikulum mata pelajaran mulok bersifat opsional. artinya mata pelajaran smp mata pelajaran ipa mata pelajaran bahasa indonesia mata pelajaran ips mata pelajaran bahasa inggris mata pelajaran sd kelas 1
data mengenai mata pelajaran favorit dikumpulkan melalui cara
soal semua mata pelajaran sd kelas 1 semester 2 mata pelajaran smk mata pelajaran kelas 1 sd mata pelajaran matematika mata pelajaran ujian sekolah sd 2022
bahasa arab mata pelajaran mata pelajaran jurusan ips mata pelajaran sd kelas 1 2021 mata pelajaran sbdp mata pelajaran kuliah mata pelajaran pkn
bahasa inggrisnya mata pelajaran mata pelajaran sma jurusan ipa kelas 10 mata pelajaran untuk span-ptkin mata pelajaran ppkn mata pelajaran ips sma mata pelajaran tik
nama nama mata pelajaran dalam bahasa inggris mata pelajaran pkn sd mata pelajaran mts mata pelajaran pjok
nama nama mata pelajaran dalam bahasa arab mata pelajaran bahasa inggrisnya mata pelajaran bahasa arab
seorang pengajar mata pelajaran akuntansi di sekolah berprofesi sebagai
nama mata pelajaran dalam bahasa jepang
hubungan bidang studi pendidikan kewarganegaraan dengan mata pelajaran lainnya
dalam struktur kurikulum mata pelajaran mulok bersifat opsional artinya mata pelajaran dalam bahasa arab
tujuan mata pelajaran seni rupa adalah agar siswa